Nội dung từ Loigiaihay.Com
Em hãy tìm hiểu và nêu một số ứng dụng của phương pháp điện phân trong thực tiễn.
Nêu các ứng dụng của điện phân trong thực tiễn từ thông tin trong SGK.
- Sản xuất kim loại: Trong công nghiệp, các kim loại mạnh (Na, K, Ca, Mg, Al,…) được điều chế bằng phương pháp điện phân nóng chảy, các kim loại yếu và trung bình được điều chế bằng phương pháp điện phân dung dịch.
- Tinh chế kim loại: các kim loại từ nguồn kim loại thô được tinh chế bằng phương pháp điện phân.
- Mạ điện: ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.

Các bài tập cùng chuyên đề
Bài 1 :
Muốn mạ đồng một tấm sắt có diện tích tổng cộng $200cm^2$, người ta dùng tấm sắt làm catốt của một bình điện phân đựng dung dịch $CuSO_4$ và anốt là một thanh đồng nguyên chất, rồi cho dòng điện có cường độ $I = 10A$ chạy qua trong thời gian $2$ giờ $40$ phút $50$ giây. Bề dày lớp đồng bám trên mặt tấm sắt là bao nhiêu? Biết đồng có $A = 64$, $n = 2$ và có khối lượng riêng $ρ = 8,9.10^3 kg/m^3$
-
A.
$0,0118cm$
-
B.
$0,106cm$
-
C.
$0,018cm$
-
D.
$0,016cm$
Bài 2 :
Để mạ đồng hai mặt của một tấm sắt có diện tích mỗi mặt là 25cm2, người ta dùng nó làm catot của một bình điện phân có anot bằng đồng nhúng trong dung dịch CuSO4 rồi cho dòng điện có cường độ I = 10A chạy qua trong thời gian 1 giờ 20 phút. Biết ACu = 64, nCu = 2 và khối lượng riêng của đồng là ρCu = 8,9g/cm3. Bề dày của lớp mạ là
-
A.
0,0358cm
-
B.
0,358cm
-
C.
3,58cm
-
D.
35,8cm
Bài 3 :
Một vật kim loại diện tích 120 cm2 được mạ niken. Dòng điện chạy qua bình điện phân có cường độ 0,30 A và thời gian mạ là 5 giờ. Xác định độ dày của lớp niken phủ đểu trên mặt vật kim loại. Niken (Ni) có khối lượng mol là A = 58,7 g/mol, hoá trị n = 2 và khối lượng riêng D = 8,8.103kg/m3, lấy số Fa-ra-đây F = 96500 C/mol. Độ dày của lớp niken phủ đều trên mặt vật kim loại là
-
A.
15,6μm.
-
B.
1,56mm
-
C.
1,56μm
-
D.
0,156mm
Bài 4 :
a) Liệt kê một số đồ vật được mạ kim loại và nêu tác dụng của việc mạ đó.
b) Kể tên một số kim loại được sản xuất bằng phương pháp điện phân.
Bài 5 :
Tìm hiểu ứng dụng của nước Javel. Đề xuất thí nghiệm đơn giản để chứng minh rằng dung dịch nước Javel có tính tẩy màu.
Bài 6 :
Tìm hiểu trong thực tế và chỉ ra những ví dụ về việc sử dụng mạ điện với mục đích bảo vệ, mạ điện với mục đích trang trí.
Bài 7 :
Hãy đề xuất và trình bày cách mạ đồng (Cu) lên một đồ vật làm từ sắt (Fe) bằng phương pháp điện phân.
Bài 8 :
Một sinh viên thực hiện quá trình điện phân dung dịch NaCl bão hòa bằng hệ điện phân sử dụng các điện cực than chì và có màng ngăn xốp. Sau một thời gian bạn sinh viên ngắt dòng điện và thu được dung dịch X. Trong thí nghiệm trên, phát biểu nào sau đây đúng khi nói về dung dịch X?
-
A.
Dung dịch X làm phenolphtalein chuyển sang màu xanh.
-
B.
Dung dịch X làm phenolphtalein chuyển sang màu hồng.
-
C.
Dung dịch X làm quỳ tím chuyển sang màu hồng.
-
D.
Dung dịch X không làm phenolphtalein hay quỳ tím đổi màu.
Bài 9 :
NaCl + H2O → X + Y↑ + Z↑ (1)
(anode) (cathode)
X + CO2 (dư) →T (2)
Phát biểu nào sau đây đúng?
-
A.
Chất khí Z có thể khử được CaO thành Ca ở nhiệt độ cao
-
B.
Dung dịch X có tính tẩy màu, sát trùng, thường gọi là Javel
-
C.
Chất T được dùng làm thuốc giảm đau dạ dày
-
D.
Chất khí Y không có màu, mùi, vị và Y có thể duy trì sự cháy.
Bài 10 :
Phương trình hóa học nào sau đây biểu diễn quá trình điều chế kim loại bằng phương pháp điện phân nóng chảy?
-
A.
CaCl2 → Ca + Cl2.
-
B.
Fe2O3 + 3CO → 2Fe + 3CO2
-
C.
Fe + CuSO4 → MgSO4 + Cu.
-
D.
2NaCl + 2H2O → 2NaOH + H2 + Cl2.
Bài 11 :
Trong công nghiệp, việc tinh chế đồng từ đồng thô được thực hiện bằng phương pháp điện phân dung dịch với anode làm bằng
-
A.
graphite.
-
B.
vàng.
-
C.
thép.
-
D.
đồng thô.
Bài 12 :
Trong các chất sau: CuBr2; AgNO3; HCl; NaOH; CaCl2; H2SO4; Al2O3. Bao nhiêu chất có thể vừa điện phân nóng chảy, vừa điện phân dung dịch?
-
A.
4
-
B.
3
-
C.
2
-
D.
1
Bài 13 :
Hòa tan 42,5 g AgNO3 vào nước được dung dịch X, sau đó điện phân dung dịch X. Sau phản ứng thấy khối lượng dung dịch X giảm 11,6 gam. Hiệu suất của quá trình điện phân là:
-
A.
60%.
-
B.
50%.
-
C.
70%.
-
D.
40%.
Bài 14 :
Trong công nghiệp người ta điều chế Al bằng phương pháp điện phân nóng chảy Al2O3 như sau:
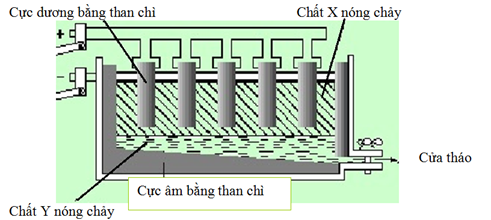
Cho các phát biểu:
(a) Chất X là Al nóng chảy.
(b) Chất Y là hỗn hợp Al2O3 và criolit nóng chảy.
(c) Na3AlF6 (criolit) được thêm vào oxit nhôm trong điện phân nóng chảy sẽ tạo được một hỗn hợp chất điện li nổi lên trên bảo vệ nhôm nóng chảy khỏi bị oxi hóa bởi O2 không khí.
(d) Trong quá trình điện phân, ở anot thường xuất hiện hỗn hợp khí có thành phần là CO, CO2 và O2.
(e) Trong quá trình điện phân, cực âm luôn phải được thay mới do điện cực làm bằng graphit (than chì) nên bị khí sinh ra ở cực dương ăn mòn.
Số phát biểu đúng là
-
A.
1
-
B.
3
-
C.
2
-
D.
4
Bài 15 :
Cho sơ đồ phản ứng sau:
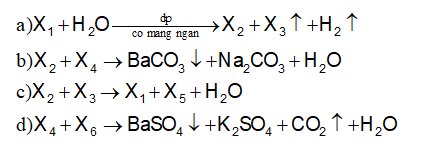
Các chất X2, X5, X6 theo thứ tự là
-
A.
NaOH, NaClO, KHSO4.
-
B.
KOH, KClO3, H2SO4.
-
C.
KOH, KClO3, H2SO4.
-
D.
NaOH, NaClO, H2SO4.
Bài 16 :
Để sản xuất cùng một lượng kim loại: nhôm từ Al(NO3)3, vàng từ Au(NO3)3, kẽm từ Zn(NO3)2 thi chi phí sản xuất kim loại nào tốn kém nhất nếu chỉ xem xét về chi phí sử dụng điện?
Bài 17 :
Ở điều kiện thường, hydrogen chloride là một chất khí, dễ tan trong nước, khi hòa tan vào nước thu được dung dịch hydrochloric acid. Cho sơ đồ điện phân dung dịch hydrochloric acid, điện cực trơ như hình bên dưới:
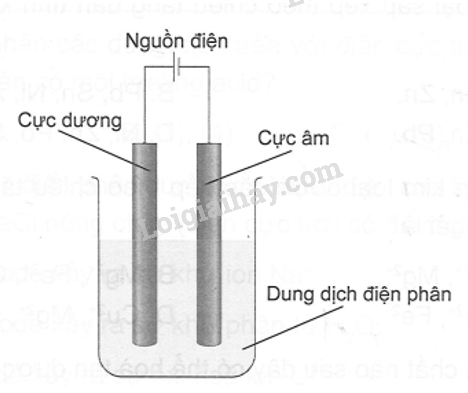
Hoàn thành các yêu cầu sau:
a, Gọi tên chất điện phân
b, Xác định các ion có trong chất điện phân và xác định chúng sẽ di chuyển về phía điện cực nào
c, Nêu hiện tượng xảy ra ở cực âm
d, Trình bày phương pháp hóa học để nhận biết sản phẩm sinh ra ở cực âm
e, Nêu hiện tượng xảy ra ở cực dương
g, Trình bày phương pháp hóa học để nhận biết sản phẩm sinh ra ở cực dương
Bài 18 :
Hãy trình bày cách mạ bạc cho một chiếc nhẫn đồng bằng phương pháp điện phân
Bài 19 :
Điện phân với điện cực trơ, có màng ngăn những dung dịch sau: NaCl, CuSO4, K2SO4, AgNO3, CuCl2. Dung dịch sau điện phân có pH
Bài 20 :
Cách nào sau đây không được dùng để điều chế NaOH?
A. Điện phân dung dịch NaCl có màng ngăn xốp, điện cực trơ
B. Cho dung dịch Ca(OH)2 tác dụng với dung dịch Na2CO3
C. Cho Na2O tác dụng với nước.
D. Dẫn khí NH3 vào dung dịch Na2CO3
Bài 21 :
Điện phân với điện cực trơ, có màng ngăn các dung dịch sau: KCl, CuSO4,AgNO3, CuCl2, MgCl2, NiSO4, ZnCl2. Số dung dịch sau điện phân có pH
A. 2 B. 3 C. 4 D. 5
Bài 22 :
Điện phân dung dịch gồm NaCl và HCl (điện cực trơ, có màng ngăn). Trong quá trình điện phân, giá trị pH của dung dịch thu được so với dung dịch ban đầu là ?
A. Không thay đổi B. Giảm xuống
C. Tăng lên sau đó giảm xuống D. Tăng lên
Bài 23 :
Điện phân 200 mL dung dịch CuSO4 nồng độ x mol/L với điện cực trơ. Sau một thời gian thu được dung dịch Y vẫn còn màu xanh, có khối lượng giảm 8 g so với dung dịch ban đầu. Cho 16,8 g bột sắt vào Y, sau khi các phản ứng xảy ra hoàn toàn, thu được 12,4 g kim loại. Giá trị của x là bao nhiêu?
Bài 24 :
Điện phân V lít dung dịch CuCl2 0,5 M với điện cực trơ. Khi dừng điện phân thu được dung dịch X và 1,86 lít khí Cl2 (đkc) duy nhất ở anode. Toàn bộ dung dịch X tác dụng vừa đủ với 12,6 g Fe. Giá trị của V là bao nhiêu?
Bài 25 :
Tiến hành điện phân dung dịch CuSO4 với anode bằng đồng. Để hòa tan 100 g đồng ở anode trong 8 giờ thì cần cường độ dòng điện bằng bao nhiêu ampe? (Làm trong kết quả đến phần mười).
Bài 26 :
Để mạ 5,0 g bạc lên một đĩa sắt khi điện phân dung dịch chứa \({{\rm{[Ag(N}}{{\rm{H}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{]}}^{\rm{ + }}}\)với dòng điện có cường độ 1,5 A không đổi cần thời gian t phút.
Cho biết:
- Quá trình khử tại cathode: \({{\rm{[Ag(N}}{{\rm{H}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{]}}^{\rm{ + }}}\)+ 1e → Ag + 2NH3.
- Điện lượng q = It = ne. F, F = 96 500 C/mol.
Giá trị của t là bao nhiêu? (Làm trong kết quả đến phần mười).
Bài 27 :
Điện phân dung dịch CuSO4 với điện cực trơ. Sau một thời gian, ở cathode thu được 1,28 g Cu và ở anode có V mL khí O2 (25oC, 1 bar) bay ra.
Giá trị của V là
A. 495,8.
B. 124,0.
C. 247,9.
D. 743,7.
Bài 28 :
Trong quá trình điện phân KCl nóng chảy với các điện cực trơ, ở cathode xảy ra quá trình
A. oxi hóa ion Z. B. khử ion \({{\rm{K}}^{\rm{ + }}}\). C. oxi hóa ion \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\). D. khử ion \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\).
Bài 29 :
Trong quá trình mạ bạc cho một chiếc vòng bằng thép thì ở anode xảy ra quá trình
A. Ag → \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\)+ 1e. B. Fe → \({\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}\)+ 2e.
C. 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e. D. C → \({{\rm{C}}^{{\rm{4 + }}}}\)+ 4e.
Bài 30 :
a) Kim loại càng mạnh thì thế điện cực chuẩn càng âm.
b) Khi tạo thành pin điện hoá, kim loại mạnh hơn sẽ đóng vai trò là cathode.
c) Điện phân dung dịch CuSO4, cứ thu được 1 moi Cu thì khối lượng dung dịch giảm 80 g.
d) Để bảo vệ đồ vật bằng kim loại, nên gắn chúng với những mảnh kim loại yếu hơn.












