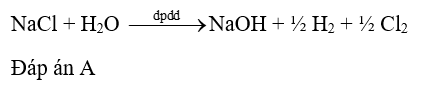Đề thi giữa kì 2 Hóa 12 Chân trời sáng tạo - Đề số 2Cặp oxi hóa – khử của kim loại làĐề bài
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Cặp oxi hóa – khử của kim loại là
Câu 2 :
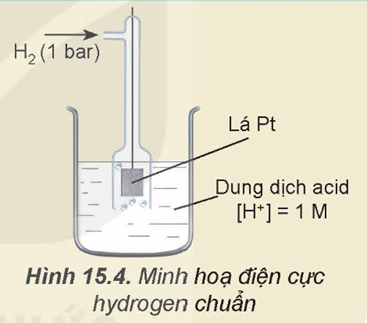
Cho hình minh họa điện cực hydrogen chuẩn như sau:
Cho biết tại ranh giới giữa lá Pt và dung dịch chất điện ly tồn tại cân bằng nào sau đây?
Câu 3 :
Phản ứng nào xảy ra ở cathode trong quá trình điện phân MgCl2 nóng chảy?
Câu 4 :
Ứng dụng nào sau đây không phải là ứng dụng của phương pháp điện phân?
Câu 5 :
Sản phẩm thu được trong quá trình điện phân dung dịch NaCl có màng ngăn xốp là
Câu 6 :
Vai trò của cầu muối trong pin điện hóa là
Câu 7 :
Kim loại có tính dẻo là nhờ:
Câu 8 :
Bản chất của liên kết kim loại:
Câu 9 :
Khi pin điện hoá Zn-Cu hoạt động, phản ứng xảy ra ở cathode là
Câu 10 :
Cấu hình electron của Sodium (Z = 11) là
Câu 11 :
Dãy kim loại tác dụng được với nước ở nhiệt độ thường là
Câu 12 :
Thực hiện thí nghiệm sau: Cho đinh sắt (iron) vào cốc. Thêm tiếp 2 – 3 mL dung dịch CuSO4 1M. Sau 5 phút, dùng kẹp lấy đinh sắt (iron) ra khỏi dung dịch. Hiện tượng quan sát được là:
Phần 2. Câu hỏi đúng, sai
Câu 1 :
Dựa vào giá trị thế điện cực chuẩn của hai cặp oxi hoá – khử có thể dự đoán được vai trò của mỗi chất và chiều phản ứng xảy ra giữa chúng như sau: a) Cặp có thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn.
Đúng
Sai
b) Dạng oxi hoá của cặp có giá trị thế điện cực chuẩn lớn hơn là chất oxi hoá.
Đúng
Sai
c) Cặp có thế điện cực chuẩn lớn hơn thì dạng khử có tính khử yếu hơn.
Đúng
Sai
d) Dạng khử của cặp có giá trị thế điện cực chuẩn lớn hơn khử dạng oxi hoá của cặp có giá trị thế điện cực chuẩn nhỏ hơn.
Đúng
Sai
Câu 2 :
Tiến hành thí nghiệm điện phân dung dịch CuSO4 với hai điện cực bằng than chì, khi dung dịch vẫn còn màu xanh thì dừng điện phân. a) Tại anode xảy ra quá trình khử nước.
Đúng
Sai
b) Thứ tự điện phân ở cathode là Cu2+ , H2O.
Đúng
Sai
c) pH dung dịch điện phân tăng dần trong thời gian điện phân.
Đúng
Sai
d) Nồng độ ion Cu2+ giảm dần trong thời gian điện phân.
Đúng
Sai
Phần 3. Trả lời ngắn
Câu 1 :
Những ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) dưới lòng đất được quấn quanh bởi những vòng kim loại để chống ăn mòn bằng phương pháp điện hoá. Có bao nhiêu kim loại có thể làm thành vòng trong số các kim loại sau: Na, Mg, Zn, Fe, Cu, Ag? Đáp án:
Câu 2 :
Cho thế điện cực chuẩn của các cặp oxi hoá – khử của kim loại:
Ở điều kiện chuẩn, có bao nhiêu ion kim loại oxi hoá được Fe thành Fe2+? Đáp án:
Câu 3 :
Hoà tan hết 1,635 g kim loại R (hoá trị II) vào dung dịch H2SO4 loãng, thu được 619,75 mL khí H2 (250 C, 1 bar). Nguyên tử khối của kim loại R là bao nhiêu ? (Làm tròn kết quả đến phần mười) Đáp án:
Câu 4 :
Người ta mạ nickel lên mẫu vật kim loại bằng phương pháp mạ điện trong bể mạ chứa dung dịch nickel sulfate với cường độ dòng diện 2,5A. Kích thước mẫu vật kim loại hình trụ đặc có bán kính 2,5cm, cao 20cm. Lớp mạ nickel dày 0,4 mm. Tính thời gian (giờ) cần thực hiện. Biết: Nikel có khối lượng riêng D = 8,9 g/cm3; khối lượng mol nguyên tử là 58,7(g/mol), lấy π là 3,14. Đáp án:
Câu 5 :
Trong công nghiệp luyện kim, quặng blende có thành phần chính là zinc sulfide (ZnS) được sử dụng làm nguyên liệu để sản xuất zinc. Quá trình xảy ra theo các giai đoạn: ZnS(s) + 3/2O2 (g) → ZnO(s) + SO2 (g) (1) ZnO(s) + C(s) → Zn(s) + CO(g) (2)
Nhiệt lượng cần cung cấp để sản xuất 1 tấn Zn ở (2) là x.106 ( Làm tròn kết quả đến phần mười). Giá trị của x là? Đáp án:
Câu 6 :
Cho 10,8 g kim loại M phản ứng hoàn toàn với khí chlorine dư, thu được 53,4g muối. Phân tử khối của M là? Đáp án:
Câu 7 :
Biết \(E_{pin}^o(Mg - Fe)\)= 1,93V và \(E_{F{e^{2 + }}/Fe}^o = - 0,44V\). Giá trị \(E_{M{g^{2 + }}/Mg}^o\)là? Đáp án:
Câu 8 :
Điện phân dung dịch CuSO4 (điện cực trơ) cho đến khi ở cathode thu được 3,2 gam kim loại thì thể tích khí (đkc) thu được ở anode là V (L). Giá trị của V gần nhất là? Đáp án:
Phần 4. Tự luận
Lời giải và đáp án
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Cặp oxi hóa – khử của kim loại là
Đáp án : B Phương pháp giải :
Dựa vào cặp oxi hóa – khử của kim loại. Lời giải chi tiết :
Cặp oxi hóa – khử của kim loại là dạng oxi hóa và dạng khử tương ứng của một nguyên tố kim loại. Đáp án B
Câu 2 :
Cho hình minh họa điện cực hydrogen chuẩn như sau:
Cho biết tại ranh giới giữa lá Pt và dung dịch chất điện ly tồn tại cân bằng nào sau đây?
Đáp án : C Phương pháp giải :
Dựa vào pin điện Galvani. Lời giải chi tiết :
Ranh giới giữa lá Pt và dung dịch chất điện ly tồn tại cân bằng 2H+ + 2e ⥦ H2 Đáp án C
Câu 3 :
Phản ứng nào xảy ra ở cathode trong quá trình điện phân MgCl2 nóng chảy?
Đáp án : B Phương pháp giải :
Dựa vào phương pháp điện phân nóng chảy. Lời giải chi tiết :
Ở cathode, xảy ra quá trình khử ion Mg2+ Đáp án B
Câu 4 :
Ứng dụng nào sau đây không phải là ứng dụng của phương pháp điện phân?
Đáp án : D Phương pháp giải :
Dựa vào ứng dụng của điện phân Lời giải chi tiết :
Ứng dụng của phương pháp điện phân không tìm hiểu tính chất của kim loại. Đáp án D
Câu 5 :
Sản phẩm thu được trong quá trình điện phân dung dịch NaCl có màng ngăn xốp là
Đáp án : A Phương pháp giải :
Dựa vào phương pháp điện phân dung dịch. Lời giải chi tiết :
Câu 6 :
Vai trò của cầu muối trong pin điện hóa là
Đáp án : B Phương pháp giải :
Dựa vào cấu tạo pin điện Galvani Lời giải chi tiết :
Cầu muối có tác dụng làm câu bằng điện tích trong dung dịch. Đáp án B
Câu 7 :
Kim loại có tính dẻo là nhờ:
Đáp án : B Phương pháp giải :
Dựa vào tính chất vật lí của kim loại. Lời giải chi tiết :
Kim loại có tính dẻo là nhớ các electron tự do chuyển động qua lại giữa các lớp mạng, giữ cho các lớp mạng không tách rời nhau. Đáp án B
Câu 8 :
Bản chất của liên kết kim loại:
Đáp án : C Phương pháp giải :
Dựa vào đặc điểm liên kết kim loại. Lời giải chi tiết :
Bản chất của liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron tự do trong mạng tinh thể với các ion dương ở nút mạng. Đáp án C
Câu 9 :
Khi pin điện hoá Zn-Cu hoạt động, phản ứng xảy ra ở cathode là
Đáp án : A Phương pháp giải :
Dựa vào quá trình xảy ra ở pin điện hóa. Lời giải chi tiết :
Ở cathode xảy ra quá trình khử Cu2+ + 2e → Cu Đáp án A
Câu 10 :
Cấu hình electron của Sodium (Z = 11) là
Đáp án : B Phương pháp giải :
Dựa vào đặc điểm cấu tạo của kim loại. Lời giải chi tiết :
Cấu hình electron của Na là: 1s22s22p63s1 Đáp án B
Câu 11 :
Dãy kim loại tác dụng được với nước ở nhiệt độ thường là
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết :
Na, K, Ca, Ba có thể tác dụng với nước ở nhiệt độ thường. Đáp án C
Câu 12 :
Thực hiện thí nghiệm sau: Cho đinh sắt (iron) vào cốc. Thêm tiếp 2 – 3 mL dung dịch CuSO4 1M. Sau 5 phút, dùng kẹp lấy đinh sắt (iron) ra khỏi dung dịch. Hiện tượng quan sát được là:
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết :
Hiện tượng quan sát được: Fe tan dần ra, có lớp rắn màu đỏ bám lên đinh sắt. Đáp án C
Phần 2. Câu hỏi đúng, sai
Câu 1 :
Dựa vào giá trị thế điện cực chuẩn của hai cặp oxi hoá – khử có thể dự đoán được vai trò của mỗi chất và chiều phản ứng xảy ra giữa chúng như sau: a) Cặp có thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn.
Đúng
Sai
b) Dạng oxi hoá của cặp có giá trị thế điện cực chuẩn lớn hơn là chất oxi hoá.
Đúng
Sai
c) Cặp có thế điện cực chuẩn lớn hơn thì dạng khử có tính khử yếu hơn.
Đúng
Sai
d) Dạng khử của cặp có giá trị thế điện cực chuẩn lớn hơn khử dạng oxi hoá của cặp có giá trị thế điện cực chuẩn nhỏ hơn.
Đúng
Sai
Đáp án
a) Cặp có thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn.
Đúng
Sai
b) Dạng oxi hoá của cặp có giá trị thế điện cực chuẩn lớn hơn là chất oxi hoá.
Đúng
Sai
c) Cặp có thế điện cực chuẩn lớn hơn thì dạng khử có tính khử yếu hơn.
Đúng
Sai
d) Dạng khử của cặp có giá trị thế điện cực chuẩn lớn hơn khử dạng oxi hoá của cặp có giá trị thế điện cực chuẩn nhỏ hơn.
Đúng
Sai
Phương pháp giải :
Dựa vào giá trị thế điện cực chuẩn của kim loại. Lời giải chi tiết :
a) đúng b) đúng c) đúng d) sai, dạng khử của cặp có giá trị thế điện cực chuẩn nhỏ hơn khử dạng oxi hóa của cặp có giá trị thế điện cực chuẩn nhỏ hơn.
Câu 2 :
Tiến hành thí nghiệm điện phân dung dịch CuSO4 với hai điện cực bằng than chì, khi dung dịch vẫn còn màu xanh thì dừng điện phân. a) Tại anode xảy ra quá trình khử nước.
Đúng
Sai
b) Thứ tự điện phân ở cathode là Cu2+ , H2O.
Đúng
Sai
c) pH dung dịch điện phân tăng dần trong thời gian điện phân.
Đúng
Sai
d) Nồng độ ion Cu2+ giảm dần trong thời gian điện phân.
Đúng
Sai
Đáp án
a) Tại anode xảy ra quá trình khử nước.
Đúng
Sai
b) Thứ tự điện phân ở cathode là Cu2+ , H2O.
Đúng
Sai
c) pH dung dịch điện phân tăng dần trong thời gian điện phân.
Đúng
Sai
d) Nồng độ ion Cu2+ giảm dần trong thời gian điện phân.
Đúng
Sai
Phương pháp giải :
Dựa vào phương pháp điện phân dung dịch. Lời giải chi tiết :
a) Sai, Tại anode xảy ra quá trình oxi hóa nước. b) Đúng c) Sai, pH dung dịch điện phân giảm dần trong thời gian điện phân vì sinh ra ion H+ tại cực anode. d) Đúng
Phần 3. Trả lời ngắn
Câu 1 :
Những ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) dưới lòng đất được quấn quanh bởi những vòng kim loại để chống ăn mòn bằng phương pháp điện hoá. Có bao nhiêu kim loại có thể làm thành vòng trong số các kim loại sau: Na, Mg, Zn, Fe, Cu, Ag? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào các biện pháp chống ăn mòn kim loại. Lời giải chi tiết :
Thép là hợp kim của sắt và carbon, nên để bảo vệ sắt cần làm vòng bằng kim loại có tính khử mạnh hơn Fe Kim loại có tính khử mạnh hơn Fe: Mg và Zn Đáp án 2
Câu 2 :
Cho thế điện cực chuẩn của các cặp oxi hoá – khử của kim loại:
Ở điều kiện chuẩn, có bao nhiêu ion kim loại oxi hoá được Fe thành Fe2+? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào thế điện cực chuẩn của các cặp oxi hóa – khử Lời giải chi tiết :
Ion kim loại Cu2+ và Ag+ oxi hóa được Fe thành Fe2+ Đáp án 2
Câu 3 :
Hoà tan hết 1,635 g kim loại R (hoá trị II) vào dung dịch H2SO4 loãng, thu được 619,75 mL khí H2 (250 C, 1 bar). Nguyên tử khối của kim loại R là bao nhiêu ? (Làm tròn kết quả đến phần mười) Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào tính chất hóa học của kim loại Lời giải chi tiết :
n H2 = 619,75.10-3 : 24,79 = 0,025 mol R + H2SO4 → RSO4 + H2 0,025 ← 0,025 MR = 1,635 : 0,025 = 65,4
Câu 4 :
Người ta mạ nickel lên mẫu vật kim loại bằng phương pháp mạ điện trong bể mạ chứa dung dịch nickel sulfate với cường độ dòng diện 2,5A. Kích thước mẫu vật kim loại hình trụ đặc có bán kính 2,5cm, cao 20cm. Lớp mạ nickel dày 0,4 mm. Tính thời gian (giờ) cần thực hiện. Biết: Nikel có khối lượng riêng D = 8,9 g/cm3; khối lượng mol nguyên tử là 58,7(g/mol), lấy π là 3,14. Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào ứng dụng của phương pháp điện phân. Lời giải chi tiết :
- Thể tích hình trụ đặc chưa mạ nickel: V1 = π.r2.h = 3,14x 2,5x2,5x20 = 392,5 cm3 - Thể tích hình trụ đã mạ nickel: V2 = π.(r+ 0,04)2.(h +0,08)= 3,14x(2,5+ 0,04)x(2,5+ 0,04) x(20+0,08) = 406,78 cm3 - Thể tích nickel đã mạ lên hình trụ là: V2 - V1 = 406,78 - 392,5= 14,28 cm3 - Khối lượng nickel cần dùng: 14,28 x 8,9 = 127,092 gam - Thời gian cần điện phân để mạ là t = m.n.F/A.I = 167146,55 giây= 46,4 giờ
Câu 5 :
Trong công nghiệp luyện kim, quặng blende có thành phần chính là zinc sulfide (ZnS) được sử dụng làm nguyên liệu để sản xuất zinc. Quá trình xảy ra theo các giai đoạn: ZnS(s) + 3/2O2 (g) → ZnO(s) + SO2 (g) (1) ZnO(s) + C(s) → Zn(s) + CO(g) (2)
Nhiệt lượng cần cung cấp để sản xuất 1 tấn Zn ở (2) là x.106 ( Làm tròn kết quả đến phần mười). Giá trị của x là? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào công thức tính biến thiên enthalpy của phản ứng Lời giải chi tiết :
\({\Delta _r}H_{298}^0\)= +130,4 × 1 – 110,5 × 1 – (–350,4 × 1) = +370,3 (kJ). Nhiệt lượng cần cung cấp = 370,3.106 /65 = 5,7.106 ( kJ)
Câu 6 :
Cho 10,8 g kim loại M phản ứng hoàn toàn với khí chlorine dư, thu được 53,4g muối. Phân tử khối của M là? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết :
2M + xCl2 → 2MClx Bảo toàn khối lượng: m M + m Cl2 = m muối → m Cl2 = 53,4 – 10,8 = 42,6g n Cl2 = 42,6 : 71 = 0,6 mol Theo PTHH: n M = \(\frac{{0,6.2}}{x} = \frac{{1,2}}{x}\)mol M M = \(\frac{{10,8}}{{\frac{{1,2}}{x}}} = 9{\rm{x}}\) Với x = 3 → MM = 27 (Al)
Câu 7 :
Biết \(E_{pin}^o(Mg - Fe)\)= 1,93V và \(E_{F{e^{2 + }}/Fe}^o = - 0,44V\). Giá trị \(E_{M{g^{2 + }}/Mg}^o\)là? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào công thức tính sức điện động của pin. Lời giải chi tiết :
\(E_{pin}^o(Mg - Fe)\) = \(E_{F{e^{2 + }}/Fe}^o\) - \(E_{M{g^{2 + }}/Mg}^o\)→ \(E_{M{g^{2 + }}/Mg}^o\)= \(E_{F{e^{2 + }}/Fe}^o\)- \(E_{pin}^o(Mg - Fe)\)= -0,44 – 1,93 = - 2,37V
Câu 8 :
Điện phân dung dịch CuSO4 (điện cực trơ) cho đến khi ở cathode thu được 3,2 gam kim loại thì thể tích khí (đkc) thu được ở anode là V (L). Giá trị của V gần nhất là? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào phương pháp điện phân dung dịch. Lời giải chi tiết :
Kim loại thu được ở cathode là copper (Cu) n Cu = 3,2 : 64 = 0,05 mol ne trao đổi = 0,05.2 = 0,1 mol Tại anode: H2O → O2 + 4H+ + 4e 0,025 ← 0,1 V O2 = 0,025.24,79 = 0,62 Lít.
Phần 4. Tự luận
Phương pháp giải :
Tính thể tích lớp mạ kẽm sau đó tính khối lượng kẽm cần dùng. Lời giải chi tiết :
+ Diện tích bề mặt = 3 m² = 30.000 cm² (1 m² = 10.000 cm²). + Độ dày = 0,05 mm = 0,005 cm. Tính thể tích lớp mạ kẽm: + Thể tích = Diện tích bề mặt * Độ dày = 30.000 cm² * 0,005 cm = 150 cm³. Tính khối lượng kẽm: + Khối lượng kẽm = Thể tích * Khối lượng riêng = 150 cm³ * 7,14 g/cm³ = 1071 g = 1,071 kg. Vậy khối lượng kẽm cần thiết để mạ 1 tấm thép là 1,071 kg. Vậy khối lượng kẽm cần thiết để mạ 3 tấm thép là 3,21 kg. Phương pháp giải :
Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết :
nFe = 0,06 mol; nS = 0,04 mol. Fe + S FeS nbđ 0,06 0,04 nsp.ư 0,02 0 0,04 hỗn hợp Y gồm: Fe (0,02 mol); FeS (0,04 mol) Fe + 2HCl FeCl2 + H2 0,02 0,02 FeS + 2HCl FeCl2 + H2S 0,04 0,04 Hỗn hợp khí Z gồm ( H2: 0,02 mol; H2S: 0,04 mol ) + O2 2H2 + O2 2H2O 0,02 0,01 2H2S + 3O2 2SO2 + 2H2O 0,04 0,06 nO2 = 0,07 mol.
|